Ciao, oggi parliamo di omeopatia! Questo perché (purtroppo) per molti il binomio autosvezzamento e omeopatia è fortissimo e inscindibile.
Prima di iniziare però desidero chiarire di cosa NON voglio parlare: non voglio parlare del fatto che su qualcuno l’omeopatia funzioni, sul fatto che funzioni con gli animali o con i bambini, sul fatto che gli omeopati siano medici o sul fatto che il pediatra abbia fatto la specializzazione in omeopatia, o sul fatto che all’università si possano studiare corsi sull’omeopatia, né mi voglio soffermare su cose come il numero di Avogadro o la memoria dell’acqua; questi temi sono stati già affrontati infinite altre volte da altri. Vi lascio a titolo informativo un paio di link. Uno del MedBunker e uno di Dario Bressanini. Mi limito, alla fine dell’articolo, a fare una domanda appena appena un po’ provocatoria. Però prima di rispondere o di commentare, dovete leggere tutto. Tranquilli, dura poco.

Detto questo e se siete ancora qui, di nuovo ciao, sono Andrea di autosvezzamento.it e in questo articolo voglio parlarvi del modo in cui viene regolata la registrazione dei medicinali omeopatici e di come questa cosa sia importante per il consumatore. Le informazioni base sono facilmente reperibili perché basta accedere al sito web dell’AIFA e cercare la procedura di registrazione dei medicinali omeopatici. In questo articolo non vi voglio stare a tartassare con infinite e noiosissime citazioni da legge e leggine che farebbero addormentare tutti. Per approfondimenti leggete questo articolo dove spiego perché le medicine omeopatiche non hanno il bugiardino e trovate tutti i riferimenti e citazioni alle varie leggi. Qui mi voglio concentrare sullo stretto necessario.
In breve, se io produttore di un nuovo medicinale che voglio commercializzare vado dall’AIFA, l’Agenzia Italiana del Farmaco, mi viene detto che ho a disposizione due strade: posso utilizzare quella che è la cosiddetta procedura semplificata oppure posso servirmi della procedura di autorizzazione ordinaria. Per i medicinali omeopatici si usa generalmente la procedura semplificata che l’AIFA riassume in due righe citando il decreto legislativo 219/2006. “L’accesso a questa procedura è consentito solo se il medicinale è in possesso dei seguenti requisiti” (cito soltanto quelli rilevanti):
“non reca specifiche indicazioni terapeutiche sull’etichetta o tra le informazioni di qualunque tipo che si riferiscono al prodotto”,
e
“ha un grado di diluizione tale da garantire la sicurezza. In ogni caso il medicinale non può contenere più di una parte per 10.000 di tintura madre, né più di un centesimo della più piccola dose di sostanza attiva eventualmente utilizzata nell’allopatia.”
Fermiamoci un attimo a commentare queste frasi, cominciando da quella che è la più importante:
“il medicinale ha un grado di diluizione tale da garantirne la sicurezza.”
Cosa vuol dire la parola sicurezza in questo contesto? È sinonimo di innocuo come ce lo dice è lo stesso decreto legislativo 219 del 2006 dove ad esempio nell’articolo 19 dice, “L’AIFA comunica agli altri Stati membri della Comunità europea ogni informazione necessaria a garantire la qualità e l’innocuità dei medicinali omeopatici prodotti e immessi in commercio nella Comunità europea.“. Se io voglio utilizzare una procedura semplificata quello che voglio registrare deve essere sicuro, deve essere innocuo. Difatti poi mi dicono che se c’è una sostanza che si potrebbe trovare anche nei medicinali, allora deve essere presente in una concentrazione pari a un centesimo della concentrazione più bassa alla quale comincio ad avere degli effetti visibili. A proposito di questo apro una piccola parentesi: questo discorso è molto simile a quello che si dice ad esempio nel campo dei pesticidi. Quando devi definire il livello di sicurezza di un pesticida, valuti la quantità che posso trovare come residuo, per dire, sulla lattuga. Quello che faccio è andare a vedere qual è la quantità di antiparassitario oltre la quale comincio ad avere degli effetti indesiderati sulla popolazione, dopodiché per ottenere un livello di sicurezza divido quella concentrazione per cento e dico che il livello massimo di residuo di quel diserbante, deve essere pari a quella quantità. Anche in questo caso, il livello di sicurezza ci dice che di quel diserbante possiamo assumerne quantità al di sotto della soglia di sicurezza tutti i giorni della nostra vita senza riscontrare effetti avversi sulla salute.
Una cosa simile succede con il medicinale omeopatico il quale, se contiene un principio attivo che sappiamo avere un effetto sull’uomo al di sopra di una certa quantità, deve contenerne meno di un centesimo della concentrazione più bassa sopra la quale comincia avere un effetto misurabile. Detto questo allora è chiaro quello che dice l’AIFA quando afferma che un medicinale omeopatico non può avere indicazioni terapeutiche. Come potrebbe, dato che tu stesso, produttore, mi hai detto che il medicinale è sicuro, è innocuo. Se è innocuo, allora non può avere indicazioni terapeutiche. Se è innocuo non può avere una posologia. E se innocuo non può avere controindicazioni. Questo è vero per definizione e non perché lo dica io. Non c’è la lobby di Big Pharma che dice che bisogna tenere nascoste le proprietà meravigliose dei medicinali omeopatici. È il produttore del medicinale omeopatico stesso che all’atto della registrazione mi dice che quel prodotto è sicuro; è innocuo, e me lo conferma dicendo che non ha effetti terapeutici. In altre parole, non puoi avere la botte piena e la moglie ubriaca. Vuoi un medicinale che non possa avere collaterali? L’omeopatico fa per te, ma il prezzo che devi pagare è che lo stesso medicinale è innocuo e senza effetti terapeutici riconosciuti.
Allora mi si chiederà se esistono dei medicinali omeopatici che abbiano effetti terapeutici. Ottima domanda, e difatti anche l’AIFA ci ha pensato perché se continuiamo a leggere la pagina sulla registrazione dei medicinali omeopatici vediamo che
“per i medicinali omeopatici che non presentino i requisiti elencati…”
…in precedenza, ovvero per i quali le indicazioni terapeutiche ci siano,
“si applica una procedura analoga a quella prevista per i medicinali allopatici che prevede la presentazione di documentazione relativa alla qualità, sicurezza ed efficacia. In questo caso il dossier autorizzativo deve contenere studi clinici a supporto delle indicazioni terapeutiche richieste. Pertanto il medicinale omeopatico autorizzato con tale procedura sarà in possesso di indicazioni terapeutiche.”
Quindi, sì, se il produttore è in grado di provare che ci sono indicazioni terapeutiche, può avere il suo foglietto illustrativo dove può scrivere la posologia e le indicazioni proprio come qualunque altro medicinale. Però poi l’AIFA ci informa che “attualmente nessun medicinale autorizzato dall’AIFA rientra in questo tipo di procedura”. NESSUN medicinale rientra in questo tipo di procedura. La procedura esiste ma non è stata mai utilizzata.
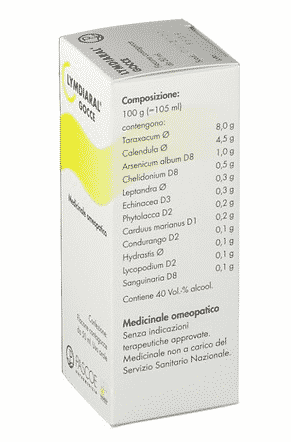
Facciamo un paio di esempi di medicinali omeopatici che ho trovato in rete. Intendiamoci, non voglio fare pubblicità a nessuno e quelli che nomino sono solo i primi due prodotti che mi sono capitati sotto mano. Cominciamo con le gocce di Lymdiaral; sulla confezione leggiamo che è un prodotto omeopatico, mentre se guardiamo dall’altra parte vediamo che è “senza indicazioni terapeutiche approvate”. Come ci aspettiamo, da nessuna parte c’è scritto che cosa dovrebbe fare questo prodotto. C’è una lista degli ingredienti, però essendo un medicinale omeopatico e non avendo indicazioni terapeutiche riconosciute questa lista degli ingredienti è una lista di ingredienti innocui. In particolare vediamo che ce ne sono di due tipi: alcune tinture madri, indicate da una specie di 0 con la barra trasversale, e delle sostanze diluite. Tuttavia, dato che questo è un medicinale omeopatico, il produttore mi garantisce che il tutto è innocuo.
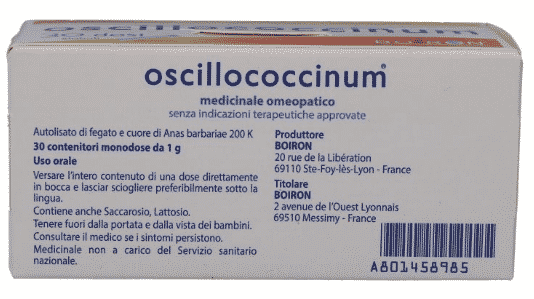
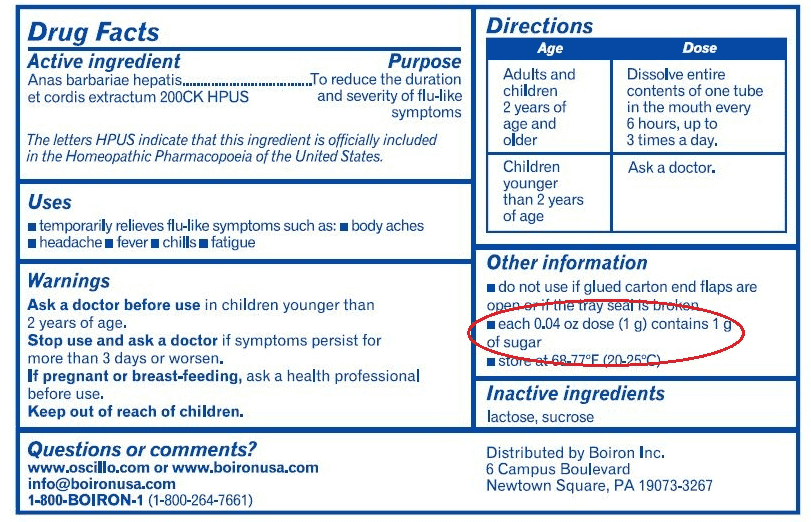
Guardiamo un altro esempio: questo è il famosissimo oscillocòccinum o oscillococcìnum, mica lo so come si pronuncia… Su questo lato della confezione non c’è scritto niente, se non il nome. Sul retro troviamo, non particolarmente in grande, “medicinale omeopatico”, quindi sappiamo cosa ci aspetta, e la scritta “senza indicazioni terapeutiche approvate” e non c’è nient’altro. Più interessante invece se guardiamo il corrispettivo americano: vedete la confezione è simile però ci stanno ulteriori informazioni. Qui dice che non dà sonnolenza, non interferisce con altri medicinali, e lavora naturalmente con il tuo corpo – che non so bene cosa voglia dire. Inoltre qui in alto vedete una specie di indicazioni perché veniamo informati che questo prodotto è per i dolori del corpo, il mal di testa, la febbre, i brividi, la stanchezza e riduce la durata e la severità dei sintomi dell’influenza.
Chiaramente la legislazione in America è diversa dalla nostra in quanto da noi il produttore ha scelto la procedura di registrazione semplificata in quanto (IL PRODUTTORE) ci dice che il prodotto è innocuo. Tenendo questo a mente, per forza l’oscillococcinum non dà sonnolenza: è innocuo! Me l’hai detto il produttore che è innocuo non lo sto dicendo mica io… ugualmente, il fatto che non interagisca con altri farmaci… ma per forza come potrebbe interferire con altri medicinali se è innocuo. Però una cosa interessante la confezione americana ce l’ha; vediamo: qui c’è una specie di foglietto illustrativo – non sono il primo che nota questa cosa, però vale sempre la pena di ripeterla – e ci dicono che in questa confezione ci sono granuli di 1 g, e i granuli da 1 g contengono 1 g di zucchero. Scusate se mi ripeto: non è la lobby di Big Pharma che cerca di nascondermi la verità, né sono io che vado a calunniare la gente; sono loro; è il produttore che mi dice tutte queste cose, bisogna semplicemente leggere. Un granulo da 1 g contiene 1 g di zucchero.
A chi mi dice che il medicinale omeopatico agisce su una sfera diversa e non misurabile rispondo… niente cosa devo rispondere?
Quindi, in conclusione, un medicinale omeopatico per essere registrato come tale deve essere provato che è innocuo. Alcuni troveranno questo fatto offensivo; si sentiranno attaccati perché dico cose che vanno contro ciò in cui credono, però non prendetevela con me perché è questo che dice la legge ed è questo che, per rispettare la stessa legge, mi dice il produttore. Ripeto per la – non lo so – per la millesima volta in questo articolo è il produttore che LIBERAMENTE mi da le informazione.
“Ma a me però l’oscillococcinum fa effetto mi fa bene, per cui continuo a prenderlo. Che vuoi da me non stava a scocciare.”
Fai benissimo soldi sono i tuoi e ci fai quello che vuoi, però un invito: se avete notato che c’è un effetto, allora dovete andare immediatamente a denunciare il produttore perché il produttore nero su bianco mi ha detto che questo prodotto è innocuo, ma se innocuo non è perché ha un effetto prevedibile, allora bisogna fare subito una class action, denunciarli e fargli ritirare dal mercato questo prodotto fino a che non venga sottoposto alla procedura di registrazione completa, così possiamo valutarne veramente rischi e benefici.
E voi che cosa ne pensate? Sapevate che è il produttore a dover dichiarare che i suoi medicinali omeopatici sono innocui? Che ha la possibilità di usare procedura di registrazione completa, ma non se ne vuole o non se ne può avvalere? Se pensate che l’omeopatia davvero funzioni, come giustificate questo fatto? Raccontatemelo nei commenti. Ciao e alla prossima.






Una risposta